张家港医疗器械高新产业园
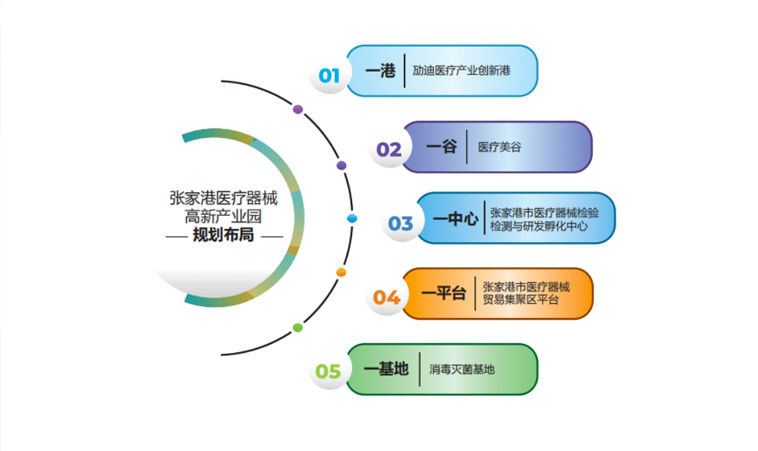
张家港医疗器械高新产业园于2019年2月经张家港市人民政府批准设立,并在同年被苏州市人民政府列入苏州首批生物医药产业园之一。园区规划总面积5785亩,核心区1880亩,其中产业园一期680亩已开发建设完成,总投资50亿元,产业园二期规划建设1200亩,计划总投资超100亿元。张家港医疗器械高新产业园围绕打造“千百十”医疗器械产业基地目标,深度布局“一港一谷一中心一平台一基地”全产业链发展新模式,即创新港、医疗美谷、检测中心、医贸平台、灭菌基地,加强高端医疗产业链强链补链,建设集研发、孵化、检测、注册、生产、灭菌、贸易为一体的高端医疗器械产业基地,打造国内最具引领力、最具辨识度的“最全产业链条”“最强产业集群”,实现入驻企业超 1000 家,实现开票销售超 100 亿元,入库税金超 15 亿元。

劢迪可可医疗器械产业创新港
位于江苏省苏州市张家港冶金园(锦丰镇),是苏州市级重大项目,总投资超过38亿元,占地面积达136.5亩,建筑面积约17万平方米。劢迪医疗器械产业创新港依托张家港医疗器械高新产业园的发展布局,构建了集医疗器械创新研发中心、成果转化中心、检测中心、公共实验平台、CDMO平台、投融资平台于一体的医疗器械闭环生态产业链。这种一体两翼三配套的发展模式,为劢迪可可公司提供了强大的产业支撑和发展动力。

医疗器械检验检测与研发孵化中心
张家港市医疗器械检验检测与研发孵化中心(简称:医路通检测),位于张家港医疗器械高新产业园,作为园区重要的产业配套技术平台。按照“服务企业、助力招商、共同成长”的总体思路,利用检测机构和科研院所的专家资源,医路通检测为企业提供注册检验、委托检测、预检测和研发测试等一系列检测服务。目前已建成并投入使用的实验室包括电气安全实验室、电磁兼容实验室(10米法和3米法两个半电波暗室)、理化分析实验室、微生物实验室、医学机器人性能实验室、光学性能实验室、可用性评价实验室、环境可靠性检测实验室等。拥有国家级CMA资质认定和CNAS实验室认可的双重资质,医路通检测可为医疗器械企业出具符合医疗器械注册法规要求的、具有市场公信力的检测报告。
- 01
张家港医疗器械高新产业园
- 02
劢迪可可医疗器械产业创新港
- 03
医疗器械检验检测与研发孵化中心